Физико-химические свойства водных растворов азотной кислоты
Рефераты по химии / Физико-химические свойства водных растворов азотной кислоты / Физико-химические свойства водных растворов азотной кислотыСтраница 1
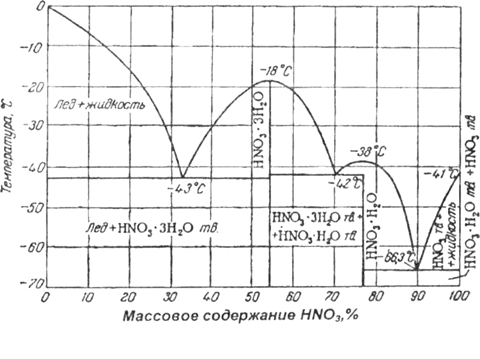
Рис. 1 - Диаграмма кристаллизации бинарной системы HNO3 – Н20
Диаграмма кристаллизации бинарной системы HNO3 - Н20, представленная на рис. 1, указывает на существование тригидрата HNO3 • 3 Н20 (53,8% HNO3) с температурой кристаллизации -18°С и моногидрата HN03 • Н20 (77,8% HNO3) с температурой кристаллизации -38°С [5]. Довольно убедительно обосновано существование полугидрата HNO3 • 0,5 Н20 (87,5% HNO3) и четверть гидрата HNO3 • 0,25 Н20 (92,5% HNO3).
На кривой кристаллизации бинарной системы HN03 - Н20 имеются три эвтектические точки: при -66,3°С (89,95% HN03), при -42°С (70,5% HN03) и при -43°С (32,7% HN03).
Температура кипения водных растворов азотной кислоты (рис. 2) при увеличении концентрации HN03 повышается, достигая максимального значения, равного 121,9°С при 68,4% HNO3 (Р=0,1МПа), затем снова понижается.
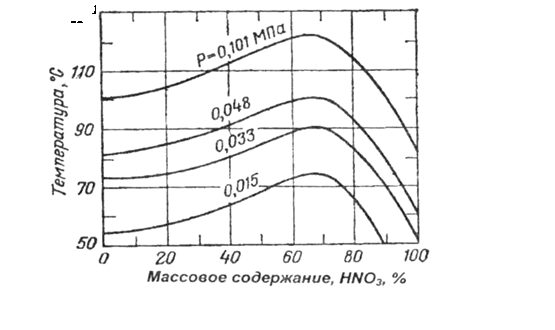
Рис. 2 - Зависимость температуры кипения водных растворов азотной кислоты от содержания HNO, при различных давлениях
Раствор, содержащий 68,4% HN03, является азеотропным, так как паровая фаза имеет такой же состав, как и жидкая фаза.
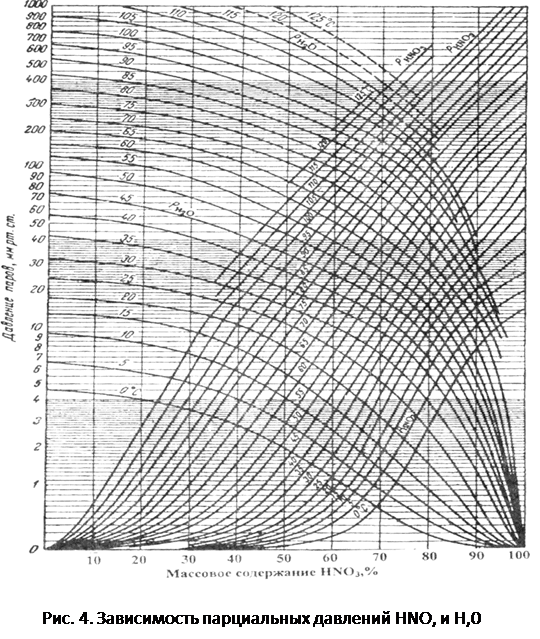
Давление паров над водными растворами азотной кислоты с повышением концентрации HN03 уменьшается, достигая минимума при содержании 68,4% HN03, а затем снова повышается (рис. 3).
Парциальное давление паров HN03 и Н20 в зависимости от температуры и состава жидкой фазы представлено на рис. 4.

В табл. 1 и на рис. 5 и 6 представлены зависимости температур кипения и массового состава паровой фазы от массового содержания жидкой фазы бинарной системы HN03 - Н20 [10].
Таблица 1 - Влияние состава жидкой фазы бинарной системы HN03 - Н20 на температуру кипения и состав паровой фазы при атмосферном давлении
|
Температура |
Массовое содержание HN03% |
Температура |
Массовое содержание HN03% | ||
|
кипения, °С |
В жидкости |
В парах |
кипения, °С |
В жидкости |
В парах |
|
100,0 |
0 |
0 |
120,05 |
68,4 |
68,4 |
|
104,0 |
18,5 |
1,25 |
116,1 |
76,8 |
90,4 |
|
107,0 |
31,8 |
5,06 |
113,4 |
79,1 |
93,7 |
|
111,8 |
42,5 |
13,4 |
110,8 |
81,0 |
95,3 |
|
114,8 |
50,4 |
25,6 |
96,1 |
90,0 |
99,2 |
|
117,5 |
57,3 |
40,0 |
88,4 |
94,0 |
99,9 |
|
119,9 |
67,6 |
67,0 |
83,4 |
100,0 |
100,0 |
Информация о химии
Алхимия
Алхимия – искусство совершенствования вещества через превращение металлов в золото и совершенствования человека путем создания эликсира жизни. Стремясь к достижению самой привлекательной для них цели – созданию неисчис ...
Y — Иттрий
ИТТРИЙ (лат. Yttrium), Y, химический элемент III группы периодической системы, атомный номер 39, атомная масса 88,9059, относится к редкоземельным элементам. Свойства: металл. Плотность 4,472 г/см3, tпл 1528 °С. Название: на ...
Mg — Магний
МАГНИЙ (лат. Magnesium), Mg (читается «магний»), химический элемент IIА группы третьего периода периодической системы Менделеева, атомный номер 12, атомная масса 24,305. Природный магний состоит из трех стабильных нукл ...


