Свойства и применение ацетона
Рефераты по химии / Соединения, изолируемые перегонкой с водяным паром - кетоны - ацетон / Свойства и применение ацетонаСтраница 1
Ацетон
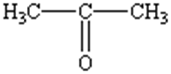
Синонимы: Диметилкетон, 2-пропанон
1.1 Свойства
Ацетон – это бесцветная горючая жидкость с характерным запахом. Смешивается со спиртом, эфиром и водой в любых соотношениях. Не образует азеотропной смеси с водой. Из водных растворов ацетон высаливается хлоридом натрия, хлоридом кальция, карбонатом калия (жидкость разделяется на два слоя). Ацетон хорошо растворяет соли многих неорганических кислот и ряд органических соединений. Ацетон получают при сухой перегонке дерева, каменного угля, а также путем синтеза. 3-й класс опасности, хорошо смешивается с водой и спиртом, смесь ацетона и воздуха взрывоопасна.
Таблица 1.1 Свойства ацетона
|
Молекулярный вес |
58,08 |
|
Температура плавления |
-95,35 0С |
|
Температура кипения |
56,24 0С |
|
Температура вспышки |
-18 °С |
|
Температура самовоспламенения |
500 °С |
|
Температурные пределы воспламенения паров в воздухе |
нижний – -20 °С верхний – 6 °С |
|
Концентрационные пределы воспламенения паров в воздухе |
нижний – 2,2% (по объему) верхний – 13% (по объему) |
|
Минимальная энергия зажигания паров в воздухе |
0,6 мДж |
|
Плотность |
0,79 г./см3 |
|
Дипольный момент при 2 Дебай |
2,72 |
|
Вязкость, сантипуазы при 15 С |
-0,3371 |
|
Поверхностное натяжениепри 20 С |
: 23,32 дины на сантиметр |
|
Показатель преломления |
1,358825 |
Ацетон обладает всеми химическими св-вами, характерными для алифатических кетонов. Он образует кристаллические соединения с гидросульфитами щелочных металлов, например с гидросульфитом натрия – (CH3)2C(OH) SO3Na.
Только сильные окислители, например щелочной раствор калия перманганата и хромовая кислота, окисляют ацетон до уксусной и муравьиной кислот и далее – до СО2 и воды.
Каталитически ацетон восстанавливается до изопропанола, амальгамамы Mg или Zn, а также цинком с уксусной кислотой – до пинакона.
Атомы водорода в ацетоне легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи (напр. натрия гидроксидом) ацетон превращается в хлороформ, который взаимодействует с ацетоном с образованием хлорэтона, применяемого как антисептик.
Ацетон окисляет вторичные спирты в присут. алкоголятов Аl до кетонов.
Ацетон вступает в альдольную конденсацию с образованием диацетонового спирта, а также в кротоновую конденсацию с образованием окиси мезитила (СН3)2С=СНСОСН3, форона (СН3)2С=-СНСОСН=С(СН3)2 и мезитиленацетона.
В присутствии сильной минеральной кислоты (например серная кислота) ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6Н4)2С(СН3)2, присоединяет цианид- ион с образованием ацетонциангидрина (CH3)2C(OH) CN.
При пиролизе (700 °С) ацетона образуются кетен СН2=С=О и метан.
1.2
Применение
В промышленности ацетон получают преимущественно так называемым кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме:
Информация о химии
Ятрохимия
Совершенно иных взглядов на цели алхимии придерживался Парацельс (1493–1541). Под таким выбранным им самим именем («превосходящий Цельса») вошел в историю швейцарский врач Филипп фон Гогенгейм. Парацельс, как и А ...
Бухнер (Buchner), Эдуард
Немецкий химик Эдуард Бухнер родился в Мюнхене, в семье профессора судебной медицины и гинекологии Мюнхенского университета Эрнста Бухнера и Фредерики (Мартин) Бухнер, дочери служащего Королевского казначейства. После смерти отца ...
Канниццаро (Cannizzaro), Станислао
Итальянский химик Станислао Канниццаро родился в Палермо; медицинское образование получил в университетах Палермо (1841–1845 гг.) и Пизы (1846–1848 гг.). Участвовал в народном восстании на Сицилии, после подавления кот ...


