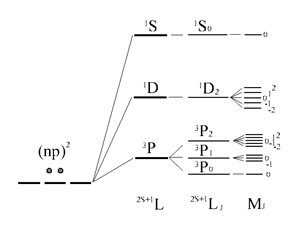
Рабочий пример. Микросостояния атома углерода.
Рефераты по химии / Состояния и уровни многоэлектронных атомов. Орбитали и термы. Векторная модель / Рабочий пример. Микросостояния атома углерода.Страница 4
Спин-орбитальный эффект приводит к тому, что термы Рассел-Саундерса расщепляются на несколько подуровней, каждый из которых характеризуется внутренним квантовым числом, принимающим значения ![]() . Внутреннее квантовое число J
. Внутреннее квантовое число J
определяет модуль суммарного момента импульса электронной оболочки, а, соответственно, суммарного магнитного момента атома.
Спин-орбитальный эффект возникает в том случае, когда оба из независимых моментов импульса электронной оболочки атома, орбитальный и спиновый не равны нулю. Если же хотя бы один из них равен нулю, то спин-орбитальный эффект не имеет места.
19. Низший из атомных термов на шкале энергии (основной терм) определяется комбинацией трёх правил Хунда. Они следующие:
1-е правило Хунда:
В пределах орбитальной конфигурации основной терм обладает
максимальной мультиплетностью.
2-е правило Хунда:
Если в пределах орбитальной конфигурации у нескольких термов мультиплетность одинакова, то у основного терма орбитальный момент наибольший и квантовое число L
максимальное.
3-е правило Хунда:
Если в пределах орбитальной конфигурации орбитальный подуровень заполнен менее, чем наполовину, среди термов, возникающих в результате спин-орбитального расщепления, низшему отвечает минимальное внутреннее квантовое число J
(нормальный терм), а при заполнении орбитального подуровня более, чем наполовину, низший терм характеризуется максимальным внутренним квантовым числом J
(обращённый терм).
Уточняя символы атомного терма Рассел-Саундерса за счёт включения спин-орбитального эффекта, записывают их в виде ![]() . Эти термы отражают схему последовательных приближений в учёте различных слагаемых полной энергии коллектива электронов в атомной оболочке в отсутствие внешних силовых полей.
. Эти термы отражают схему последовательных приближений в учёте различных слагаемых полной энергии коллектива электронов в атомной оболочке в отсутствие внешних силовых полей.
В итоге термы, возникающие в основной конфигурации атома углерода, представлены следующим образом:
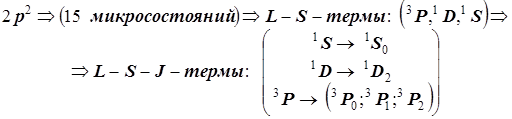
Во внешнем магнитном поле наблюдается дополнительное расщепление атомных уровней по атомному квантовому числу J. С учётом этого расщепления нумерация уровней осуществляется с помощью квантового числа MJ.
В завершение этого раздела приведём последовательность атомных уровней на каждой стадии последовательного уточнения картины взаимодействий .
Последовательность учёта электронных взаимодействий и энергетическая диаграмма атомных уровней (термов) для основной конфигурации np
2 атома C
(или Si
, .)
|
Существует очень простой приём определения основного терма атомной оболочки (мнемоническое правило Грегори).
Для этого в пределах высшего незавершённого подуровня распределяют электроны с максимально возможным спиновым распариванием. При этом по АО они распределяются таким способом, чтобы достигалось максимальное значение суммарного орбитального момента. В результате получаем микросостояние с экстремальными проекциями M Lmax и MSmax , значения которых совпадают с соответствующими числами L, S основного терма.
ПРИМЕР 1(атом C(p2)). M Lmax=1+0; ® Lmax=2; ® D; MSmax=1/2+1/2; ® Smax=1; ®
® 2Smax+1=3 (триплет) ; Терм 3
D
или точнее C (2p2) 3
D
ПРИМЕР 2(атом Ti(d2)). M Lmax=2+1; ® Lmax=3; ® F; MSmax=1/2+1/2; ® Smax=1; ®
® 2Smax+1=3 (триплет) ; Терм 3
F
или точнее Ti (3d2) 3
F
ПРИМЕР 3(атом Fe(d6)). M Lmax=2; ® Lmax=2; ® D; MSmax=5/2-1/2=2; ® Smax=2; ®
® 2Smax+1=5 (квинтет) ; Терм 5
D
или точнее Fe (3d6) 5
D
ПРИМЕР 4(атом N(p3)) . M Lmax=0; ® Lmax=0; ® S; MSmax=3/2; ® Smax=3/2; ®
® 2Smax+1=4 (квартет) ; Терм 4
S
или точнее N (2p3) 4
S
20. Анализ возбуждённой конфигурации производится по такой же схеме.
Пример 2: Первая возбужденная конфигурация атома Be
(1
s
2
2
s
1
2
p
1
)
.
Микросостояния электронной оболочки атома бериллия в основной и двух последующих возбуждённых конфигурациях: (2s2 ), (2s12p1), (2p2)
|
АО |
2s |
2p |
ML |
MS | |||
|
Ml |
0 |
+1 |
0 |
-1 | |||
|
Конфигурация | |||||||
|
2 s 2 (основ) |
|
0 |
0 | ||||
|
А |
|
|
+1 |
+1 | |||
|
Б |
|
|
0 |
+1 | |||
|
В |
|
|
-1 |
+1 | |||
|
Г |
|
|
+1 |
0 | |||
|
Д |
|
|
0 |
0 | |||
|
2 s 1 2 p 1 (1-я возб.) |
Е |
|
|
-1 |
0 | ||
|
Ж |
|
|
+1 |
0 | |||
|
З |
|
|
0 |
0 | |||
|
И |
|
|
-1 |
0 | |||
|
К |
|
|
+1 |
-1 | |||
|
Л |
|
|
0 |
-1 | |||
|
М |
|
|
-1 |
-1 | |||
|
|
|
+2 |
0 | ||||
|
2 p 2 (2-я возб.) |
|
0 |
0 | ||||
|
|
-2 |
0 | |||||
Информация о химии
Перрен (Perrin), Жан Батист
Французский физик Жан Батист Перрен родился в Лилле. Его вместе с двумя сестрами воспитывала мать, после того как их отец, офицер, умер от ран, полученных во время франко-прусской войны. Получив начальное образование в местных шко ...
Co — Кобальт
КОБАЛЬТ (лат. Cobaltum), Со, химический элемент VIII группы периодической системы, атомный номер 27, атомная масса 58,9332. Свойства: серебристо-белый металл с красноватым оттенком; плотность 8,9 г/см3, tпл 1494 °С; ферромагн ...
Лоран (Laurent), Огюст
Огюст Лоран, выдающийся французский химик-органик, создатель «теории ядер», на основе которой была построена одна из систем классификации органических соединений, родился в Ла-Фоли 14 ноября 1807 г. В 1830 г. окончил П ...